Reagente limitante
Numa reação química, o reagente limitante é aquele que será consumido por completo em primeiro lugar, fazendo com que a reacção termine. A sua determinação depende da quantidade inicial (moles) de cada um dos reagentes, e leva em conta a estequiometria da reacção.Reagente limitante
O reagente limitante de uma reação química é o reagente que se encontra presente em menor quantidade relativa, isto é, o que apresenta menor quociente entre a respectiva quantidade de substância e o coeficiente estequiométrico respectivo na equação química que traduz a reação. Em situações do quotidiano, tanto no laboratório como na indústria, as relações entre reagentes e produtos não são simples, uma vez que é necessário ter em atenção que os reagentes não existem no estado de pureza absoluta, apresentando impurezas; as quantidades relativas de reagentes raramente obedecem às proporções estequiométricas, havendo um reagente limitante e outro(s) em excesso e a quantidade obtida de cada produto nem sempre é igual à teoricamente esperada, fazendo com que o rendimento da reação seja inferior a 100%. Deste modo, torna-se importante determinar o reagente limitante de uma reação química, sendo este definido como aquele que está em defeito relativamente às proporções estabelecidas pela correspondente equação química. O reagente limitante é o reagente cuja quantidade determina a(s) quantidade(s) máxima(s) de reagente(s) que se gasta(m) e de produto(s) que se forma(m) nessa reação química. Numa reação designam-se por reagentes em excesso todos os reagentes que não sejam o reagente limitante. Se as quantidades de todos os reagentes estiverem em proporções estequiométricas, todos os reagentes são limitantes.
Determinação do reagente limitante
Exemplo de Reação Química
Para demonstrar o cálculo do reagente limitante, utilizar-se-à como exemplo a seguinte reação, que culmina com a formação de cloreto de magnésio e água:

Acertar a equação
Numa reação química e de acordo com a Lei de Lavoisier, não há nem perda nem ganho de átomos. Tal implica que o número total de átomos de cada elemento no lado esquerdo da equação deve ser sempre igual ao do lado direito. Ao proceder à determinação do reagente limitante, a equação deve ser "acertada" (ou "balanceada") por forma a cumprir a lei de Lavoisier (ver mais em estequiometria).
Na equação exibida acima encontram-se 4 átomos de hidrogênio (H), 2 de cloro (Cl), 1 de magnésio (Mg) e 2 de oxigênio (O) tanto à esquerda como à direita, pelo que já se encontra acertada.
Cálculo do reagente limitante
O reagente limitante encontra-se dividindo a quantidade (em mol) de cada reagente pelo seu índice estequiométrico. O reagente para o qual se obtiver o valor mais baixo é o limitante.
Reagente em moles
De acordo com a estequiometria da equação, dois mols de HCl reagem com um mol de Mg(OH)2. Se for preparada uma reacção entre uma mol de cada composto, o reagente limitante seria o HCl, visto que se gasta a uma proporção maior (2 de HCl por cada 1 de Mg(OH)2). Esta observação empírica é comprovada ao efectuar o cálculo indicado acima, na caixa de texto:
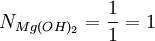

Reagente em massa
A unidade de medida mais frequentemente utilizada para quantificar os reagentes (em estado sólido) é a massa, pelo que quando apenas a massa (e não a quantidade em mol) dos reagentes é conhecida, é necessário efectuar a conversão para determinar o reagente limitante (ver mais em massa molecular.
Exemplo
Questão: Se se fizer reagir 10 gramas de HCl com 5 gramas de Mg(OH)2, qual o reagente limitante?
- Determinação da massa molecular de cada um dos reagentes:
- Determinação do número de moles, utilizando a massa molecular:
- Divisão pelos coeficientes estequiométricos:

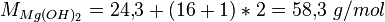

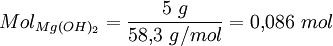
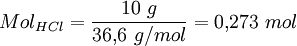


Nenhum comentário:
Postar um comentário